“A Engenharia Biomédica é uma área na qual princípios da Engenharia são utilizados na abordagem de problemas médicos e biológicos”
Dentre as subáreas da Engenharia Biomédica destaca-se a Bioengenharia. Algumas das principais características da pesquisa em Bioengenharia são:
- Predominância de pesquisa básica
- Estudo de fenômenos e sistemas biológicos
- Desenvolvimento de modelos físicos e matemáticos para melhor compreensão de fenômenos biológicos
- Experimentação com animais e preparações biológicas para teste dos modelos propostos
As pesquisas em Bioengenharia servem como base para o desenvolvimento de novas técnicas para apoio à pesquisa biológica e clínica assim como para o desenvolvimento de instrumentação médica.
Texto extraído de uma palestra proferida pelo Prof. Dr. Sérgio S. Muhlen na UMC em Dezembro de 2016
Atualmente, dentro da Bioengenharia, venho trabalhando no campo da Modelagem Matemática e Simulação Computacional da Eletrofisiologia Cardíaca. Dentro dessa linha de pesquisa destacam-se os seguintes projetos:
INTRODUÇÃO
Segundo dados da “World Health Organization” (WHO) as doenças cardiovasculares (DCV) incluindo as arritmias cardíacas, são responsáveis por cerca de 17,5 milhões de mortes anuais em todo mundo, sendo que 80% dessas mortes ocorrem em países em desenvolvimento, incluindo o Brasil. Nos EUA, de acordo com a “American Heart Association” (AHA), doenças cardiovasculares acometem 1 em cada 3 americanos e representaram a causa mortis primária em cerca de 36,6% dos óbitos registrados no ano de 2004. No Brasil, segundo dados da Sociedade Brasileira de Cardiologia (SBC), cerca de 315 mil pessoas morreram em 2009 de doenças cardíacas. Desse total, 75 mil casos foram por infarto. Esses dados apontam para a necessidade de se estudar cada vez mais o funcionamento do coração normal, para que se possa entender melhor as causas e o impacto das doenças cardiovasculares em geral e assim, contribuir para sua prevenção e desenvolvimento de novas terapias.
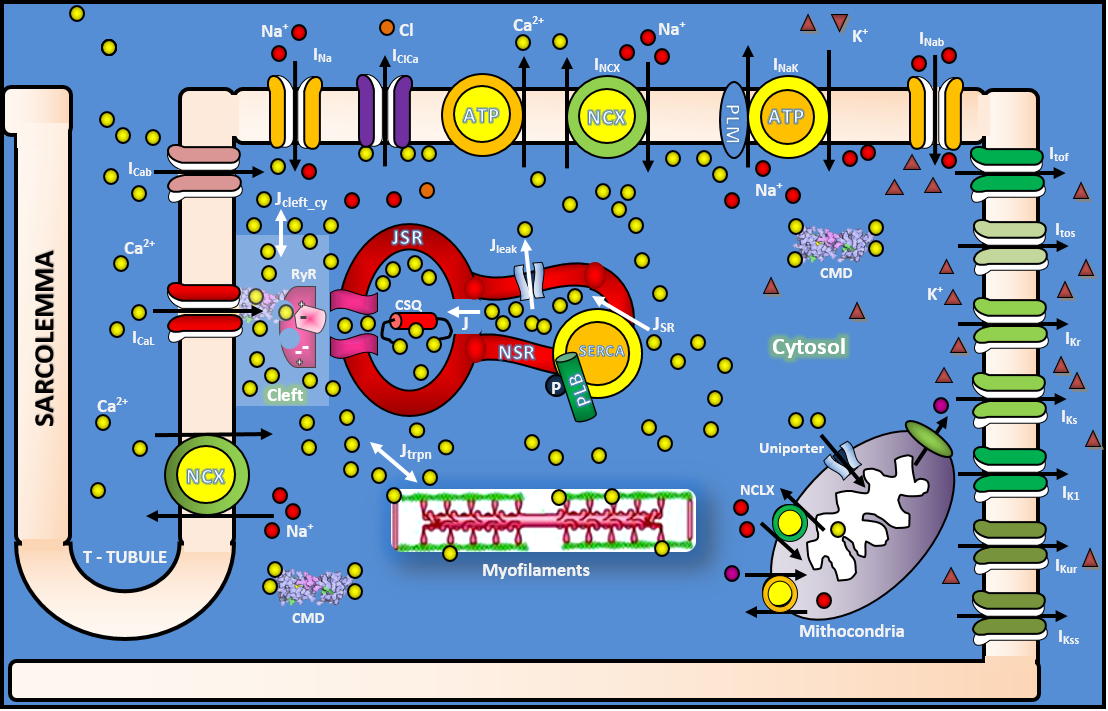
Dos íons envolvidos no complexo funcionamento do coração, o cálcio é considerado o mais importante. Ele é fundamental no processo que permite as câmaras do coração se contrair e relaxar, um processo chamado acoplamento da excitação – contração – relaxamento (ECR) que vai desde a excitação elétrica do miócito cardíaco à contração e relaxamento do coração. O cálcio é essencial no processo do acoplamento excitação – contração por ser o ativador direto dos miofilamentos que causam a contração, e o seu fluxo irregular no miócito cardíaco é uma das causas centrais de várias deficiências orgânicas e arritmias contráteis (Bers, 2001).
Nesse contexto, a formulação de novos modelos matemáticos e computacionais de miócito ventricular de mamífero aporta ferramentas importantes para entendermos os mecanismos de liberação de cálcio e para analisar de forma detalhada as causas dos diversos tipos de arritmia cardíaca, entre outros temas de pesquisa. Esses modelos fornecem dados sobre o transiente de cálcio, força contrátil na célula cardíaca e ainda permitem, além da reprodução de experimentos, investigar os efeitos de novos fármacos utilizados para o tratamento de arritmias, investigações essas que visam colaborar com hipóteses obtidas por meio da análise de dados experimentais. Alguns modelos já são capazes de produzir resultados confiáveis, que inclusive já contribuíram para o desenvolvimento de novos fármacos utilizados no tratamento de doenças cardíacas (FINK et al, 2009).
“O simulador MioLab®“
MioLab® (Laboratório de Miócito Cardíaco) é um simulador para força contrátil em miócito cardíaco de rato fundamentado na dinâmica de cálcio, e além de ser utilizado como uma ferramenta de pesquisa, devido as inúmeras animações e vídeos inseridos (parte didática do simulador), também pode ser trabalhado com um instrumento de ensino para complementar aulas sobre os conceitos básicos da fisiologia e biofísica da célula cardíaca. Na figura abaixo pode-se visualizar a tela principal do simulador.

Para maiores informações acesse:
1. SILVA, ROBSON RODRIGUES DA; BISSACO, MARCIA APARECIDA SILVA ; GOROSO, DANIEL GUSTAVO. MioLab, a rat cardiac contractile force simulator: applications to teaching cardiac cell physiology and biophysics. Computer Methods and Programs in Biomedicine (Print) , v. 122, p. 480-490, 2015.
, v. 122, p. 480-490, 2015.
2. SILVA, R. R.; GOROSO, D. G. ; BISSACO, M. A. S. MioLab: Simulator for cardiac myocyte contractile force of rat based on the dynamics of calcium. Medical Engineering & Physics , v. 35, p. 338-349, 2013.
, v. 35, p. 338-349, 2013.
Esse projeto foi desenvolvido no Núcleo de Pesquisas Tecnológicas (NPT) da Universidade de Mogi das Cruzes e conta com o apoio financeiro da FAEP (Fundação de Amparo ao Ensino e Pesquisa) e FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo) sob processo n° 2013/20220-5.
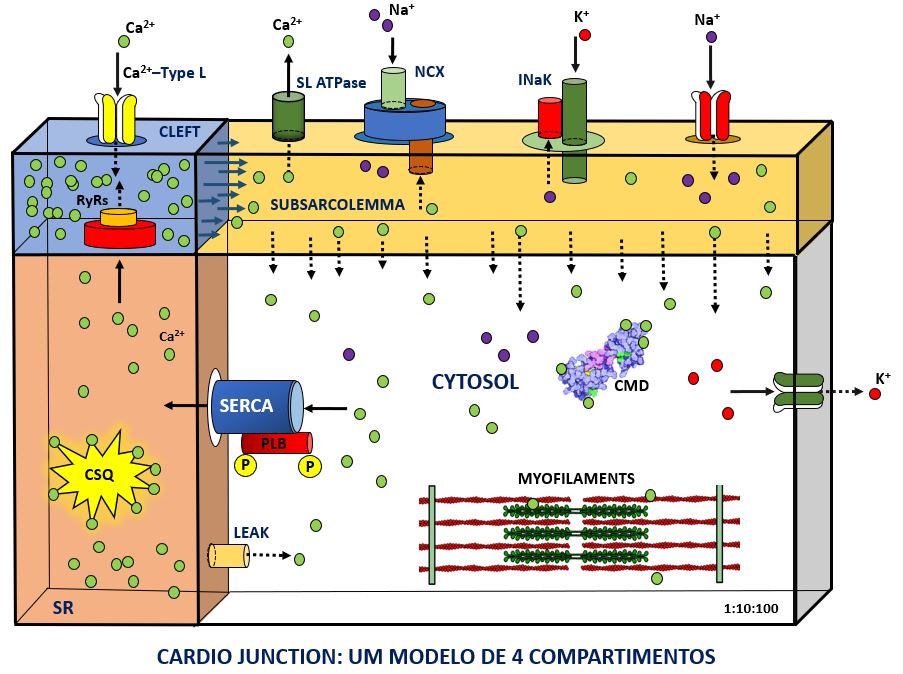
Atualmente um modelo de 4 compartimentos está em desenvolvimento e um simulador para versão WEB está sendo implementado.
A Equipe
Pesquisador Responsável:
Prof. Dr. Robson Rodrigues da Silva / UMC – UNICAMP
Pesquisadores Associados:
Prof. Dr. Daniel Gustavo Goroso / UMC
Profa. Dra. Marcia A. S. Bissaco / UMC
Prof. Dr. Ricardo Agostinho/ IFSP
Agradecimentos

The authors acknowledge the financial support from São Paulo Research Foundation – FAPESP (Grant #2013/20220-5).
O simulador MarkoLAB
O software MarkoLAB® é um simulador multiplataforma, desenvolvido em ambiente MATLAB® e LabView®, para representar a dinâmica 3D dos modelos Markovianos para os três principais canais iônicos (sódio, potássio e cálcio) e permite, a partir de gráficos dinâmicos (animados), visualizar a transição entre os mais diversos estados que o canal possuir. MarkoLAB® fornece uma maneira original de se visualizar o comportamento estocástico de um canal iônico e possibilita esclarecer conceitos, como a recuperação da inativação por cálcio versus a inativação dependente da voltagem, fato que pode ser observado quando se estuda experimentalmente o comportamento do canal de cálcio do tipo L, além de possibilitar a simplificação de alguns dos diagramas de estados, como o que representa as transições entre os estados do canal de potássio de retificação lenta (IKs), cujas perturbações em um dos seus 17 estados, causadas por efeitos de drogas ou alterações genéticas, produzem uma repolarização anormal do AP cardíaco e consequentemente arritmias (Severi et al, 2009).

Essa pesquisa foi desenvolvida no Núcleo de Pesquisas Tecnológicas (NPT) da Universidade de Mogi das Cruzes em colaboração com o Departamento de Farmacologia da Universidade da Califórnia (UCDavis) e também conta com o apoio financeiro da FAPESP.
Para maiores informações acesse:
 , v. 87, p. 258-270, 2017.
, v. 87, p. 258-270, 2017.Download do instalador MarkoLAB
1. Para instalar o simulador MarkoLAB (plataforma MATLAB) clique nos links abaixo:abaixo:
MarkoLAB v2 – Sistema Operacional: Windows
MarkoLAB v2 – Sistema Operacional: iOS
2. Para instalar o simulador MarkoLAB (plataforma LabView) clique nos link abaixo:abaixo:
MarkoLAB v1 – Sistema Operacional: Windows
“Material Suplementar“
1. Workbook MarkoLAB para versão LabView
2. Workbook MarkoLAB para versão MATLAB
4. Instrumento para avaliação da usabilidade do simulador
A Equipe
Pesquisadores Responsáveis:
Prof. Dr. Robson Rodrigues da Silva / UMC
Prof. Dr. José Luis Puglisi / California Northstate University
Pesquisadores Associados:
Prof. Dr. Daniel Gustavo Goroso / UMC e UNIFESP
Prof. Dr. Donald M. Bers / UCDavis – University California
Agradecimentos

INTRODUCTION
Cardiovascular diseases account for approximately 18 million deaths world wide per annum, 75% of which in low and middle in come countries . These data point out the need to better understand the complex phenomena underlying myocardial excitation and contractionin both physiological and pathophysiological conditions for more effective prevention and treatmentof cardiovascular diseases. In the phenomenon of excitation-contraction coupling (ECC) in the cardiac cell, the calcium ion is of fundamental importance, from its participation in the cell electric activity to the control of the contraction process. Mathematical models are useful tools in the study of physiological phenomena. However, due to differences in assumptions and formulations, discrepancy in the simulations may occur. Among the models for cardiomyocyte contraction based on Huxley´s cross-bridge cycling, those proposed by Negroni and Lascano (NLM) and Rice et al. (RWHM) are the most frequently used. This study was aimed at developing a computational tool, ForceLAB, which allows implementing different contraction models, and comparing their performance for equal Ca2+ input in both steady-state force x pCa relatiosnhip and during electrically-stimulated twitches.
This project is being developed at the Research and Technology Center of University of Mogi das Cruzes in collaboration with the Center for Biomedical Engineering of UNICAMP.
For more information access the published article: https://doi.org/10.1016/j.compbiomed.2021.104240
TEAM
Robson Rodrigues da Silva, PhD / NPT – UMC Osias Baptista S. Filho, PhD / NPT – UMC
e-mail: robson.silva@umc.br e-mail: osiasbap@gmail.com
Rosana Almada Bassani, PhD / CEB – UNICAMP José Wilson. M. Bassani, PhD / CEB – UNICAMP
e-mail: rosana@ceb.unicamp.br e-mail: bassani@ceb.unicamp.br
Matheus Leonardo Alves de Camargo, MsC / NPT / UMC
e-mail: matheus.leonardo675@gmail.com
Download – ForceLAB
Acknowledgements

The authors acknowledge the financial support from São Paulo Research Foundation – FAPESP (Grants #2013/20220-5 and 2016/18422-7).
ABSTRACT
The force-frequency relationship of cardiac muscle has intrigued researchers since its discovery in 1871 by Henry Bowditch. This property of the heart muscle is mediated primarily by β-adrenergic stimulation. The autonomic nervous system, through the sympathetic and parasympathetic nervous system, changes the heart rate at the level of the atrial sinus node and synchronously modifies the main mechanisms of the ventricular cells to meet the new energy demands. These changes occur in the conductance of ion channels, in the sensitivity of myofilaments, and in the pump activity of the sarcoplasmic reticulum, to produce an increase in contraction force and a shorter relaxation time. The challenge for researchers modeling the complex phenomenon of excitation-contraction coupling (EC) in the ventricular myocyte is to include in their models this synchronous adjustment between the increase in heart rate and possible changes in the entire cellular system. Not including this characteristic in the model implies an incomplete description of the physiological changes that influence the development of the contraction force and, consequently, the interpretation of the results obtained in the “in silico” experiments. Thus, the main objective of this project is to develop a new model of coupling of the EC to the rabbit ventricular myocyte, based on dynamic biophysical parameters dependent on the frequency of stimulation. In this new model, the pacing frequency information will be transmitted to the main mechanisms involved in the whole EC process. This new approach in mathematical modeling will reproduce a more realistic cellular behavior regarding the force-frequency relationship and will serve as insight for the improvement and development of new models.
TEAM
Robson Rodrigues da Silva, PhD / NPT – UMC Daniel Gustavo Goroso, PhD / NPT – UMC
e-mail: robson.silva@umc.br e-mail: danielg@umc.br
Jose Luis Puglisi, PhD / College of Medicine – California Northstate University
e-mail: jose.puglisi@cnsu.edu
Acknowledgements

PIBIC 2022/2023:
PIBIC 2021/2022:
DESENVOLVIMENTO DE UMA FERRAMENTA COMPUTACIONAL PARA O DIMENSIONAMENTO DE REATORES DO TIPO BATELADA (PRÊMIO DE MELHOR TRABALHO NO XXV CONGRESSO DE INICIAÇÃO CIENTÍFICA DA UMC)
PIBIC 2020/2021:
PIBIC 2019/2020:
2. ENSINO E APLICAÇÕES DOS NÚMEROS COMPLEXOS NA ENGENHARIA ELÉTRICA
PIBIC 2018/2019:
1. SCHSim: UM SIMULADOR DO SISTEMA CIRCULATÓRIO HUMANO UTILIZANDO CIRCUITOS ELÉTRICOS EQUIVALENTES
As pesquisas em Bioengenharia servem como base para o desenvolvimento de novas técnicas para apoio à pesquisa biológica e clínica, e para o desenvolvimento de instrumentação médica.
Os exemplos abaixo mostram como é importante o desenvolvimento de pesquisas voltadas para o estudo de modelos matemáticos e computacionais que tem por objetivo descrever a força de contração em células cardíacas.
1. Luva robótica “espreme” o coração para que órgão continue a bater
2. Luva robótica pode ajudar coração doente
